![]()
Steckbrief und Stoffwechselaufgaben von Natriumchlorid (Speisesalz)
Vertiefende oder ergänzende Informationen
- Einführung: Warum kann Kochsalz Probleme machen?
- Warum Kalium und Magnesium die „guten Gefährten“ von Natriumchlorid sind
- Stein- und Meersalze
1. Aufbau und Stoffwechselaufgaben
von Speisesalz
Natriumchlorid ist raffiniertes Speisesalz zu 99,9 %
Herkunft des Namens
Die Bezeichnung Natrium leitet sich aus dem Ägyptischen netjer (netjerj) bzw. aus dem Hebräischen „neter“ ab. Entstanden ist der Name in der Antike und er steht für das aus Sodaseen gewonnene Soda (= Natriumcarbonat). Soda wird unter anderem schon seit Jahrtausenden zur Glasherstellung genutzt wurde.
Chlor ist ein gasförmiges Halogen (= Salzbildner) und durch die Reaktion mit Natrium entsteht Natriumchlord. Ganz allgemein sind Chloride Salze der Chlorwasserstoffsäure (Salzsäure) und tatsächlich kann man aus NaCl Salzsäure gewinnen (durch die Reaktion mir Schwefelsäure) .
Synonym verwendete Begriffe für Natriumchlorid bzw. verschiedene Formen von Speisesalz
NaCl, Salz, Kochsalz, Tafelsalz, Siedesalz, Quellsalz, Meersalz, Steinsalz (Halit, Kristallsalz, Ursalz).
Chemische und physikalische Eigenschaften
![]()
Für den Experten
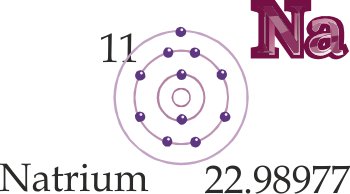
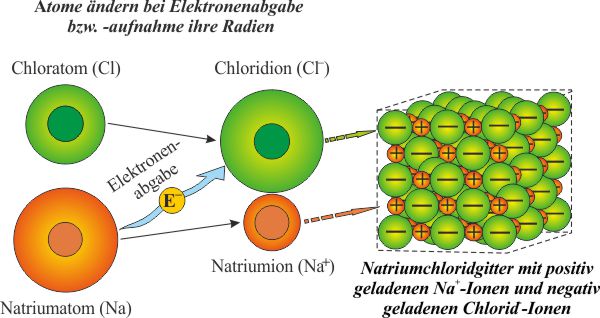
- Neutrales Atom: die Anzahl an positiven Ladungen im Atomkern entspricht der Anzahl an Elektronen in der Atomhülle (Chloratom, Natriumatom).
- Ion: elektrisch positiv oder negativ geladenes, also nicht neutrales Atom. Es entsteht, wenn es Elektronen abgibt oder aufnimmt (Chloridion, Natriumion).
- Kation: positiv geladenes Ion (Natriumion).
- Anion: negativ geladenes Ion (Chloridion).
- Molekül: Verbindung aus zwei oder mehr Atomen. Moleküle sind nach außen hin wieder elektrisch neutral (Natriumchlorid).
Das Verhältnis von Natrium zu Chlorid beträgt 1:1. Betrachtet man aber die Gewichtsanteile, ist das Chlorid aufgrund seiner höheren Masse deutlich schwerer. Der Gewichtsanteil von Natrium beträgt 39,4 %, der von Chlorid 60,6 % (2,3 Teile Natrium + 3,5 Teile Chlorid = Kochsalz).
Das regelmäßige und quadratische Kristallgitter lässt sich nicht nur im Rasterelektronenmikroskop erkennen. Auch in der Natur „stapeln“ sich die kleinen Würfel, Kante an Kante, zu größeren, durchscheinenden Formationen.

Foto: Szczecin, Poland, Lizenz: Creative Commons by-sa 2.0, abgelegt bei Wikipeida
Eigenschaften von Natriumchlorid:
- Form: fest;
- Farbe: farblos;
- Geruch: geruchlos;
- Schmelzpunkt: 801 °C;
- Siedepunkt: 1465 °C;
- Dichte: 2,17 g/cm3;
- Molmasse: 58,44 g/mol;
- Löslichkeit in Wasser: 358 g/l bei 20 °C;
- thermische Eigenschaften: setzt den Schmelzpunkt von Wasser bzw. Eis herab*.
- Vorkommen: in der ganzen Natur stark verbreitet und auch im Kosmos nachweisbar.
Kochsalzgewinnung
- Insgesamt sind etwa 50 Billiarden (50x 1015) Tonnen gelöster Mineralienverbindungen im Meerwasser enthalten. Die Hauptmineralien sind: Natriumchlorid, Kalziumcarbonat und -sulfat, Kaliumsulfat sowie Magnesiumchlorid, -sulfat und ‑bromid.[4. GEOMAR, Helmholtz-Zentrum für Ozeanforschung Kiel, „Chemische Ozeanographie“. Internet: http://www.geomar.de/forschen/fb2/fb2-ch/ueberblick/ (Stand: 11.2014).] Unter der Erde befinden sich in Salzstöcken weitere 100 Billionen Tonnen.[5. Axel Bach et al., Quarks & Co. (WDR), „Kostbares Salz“, schriftliche Ausarbeitung zur Sendung vom 19.04.2005, S. 7.] Für menschliche Zeiträume ist Salz damit praktisch unbegrenzt verfügbar.
- Lagerstätten entstanden durch die Verdunstung von Meerwasser. Da Natrium, Kalium, Calcium und Magnesium jeweils andere Löslichkeiten haben, entstanden unterschiedliche Schichten aus Kalkstein, Gips, Stein-, Kalium- und Magnesiumsalz.
- Es werden jährlich weltweit über 257 Millionen Tonnen Salz gefördert (Stand 2006); davon sind 70 % bergmännisch gewonnenes Stein- und Solesalz**, 30 % sind Meersalz.** In einer Sole liegt das Salz in Wasser gelöster Form vor (z. B. als salzhaltiges Quellwasser). Ein solches Salz wird durch die Verdampfung des Wassers gewonnen.
- Der weitaus größte Teil wird raffiniert, auch handelsübliches Meersalz. Raffiniertes Kochsalz besteht zu 99,9% aus Natriumchlorid.
- Der Natriumchlorid-Anteil von nicht raffiniertem Natursalz beträgt 96-98 %. Der Rest besteht vorwiegend aus Magnesium-, Kalium- und Calciumchlorid und Sulfaten. In winzigen Spuren sind weitere Mineralien und Spurenelemente enthalten.
2. Natriumchlorid als Bestandteil
unserer Ernährung
- Ein einzelnes, gewöhnliches Salzkorn wiegt 0,14 mg. Das ergibt über 35.000 Salzkörner pro Teelöffel.
- Maßeinheiten
- Ernährung: g oder mg (ein tausendstel Gramm)
- Küchenmaße: 1 Prise = 0,04 g, 1 Messerspitze = 0,25 g, 1 gestrichener Teelöffel = 5 g, 1 gestrichener Esslöffel = 15 g[6.Verband der Kali- und Salzindustrie e. V., „Salz als Lebensmittel. Unverzichtbar und wertvoll“, S.19. Internet: http://www.vks-kalisalz.de/uploads/tx_powermail/files/Salz-als-Lebensmittel_01.pdf (Stand: 11.2014).]
- In unbelassenen bzw. frischen Lebensmitteln ist der Natriumanteil sehr gering, während der Kaliumanteil hoch ist. In industriell hergestellten Produkten ist es genau umgekehrt (etwa 95 % unserer Natriumzufuhr erfolgt durch Speisesalz).
- Durchschnittliche Aufnahme von Kochsalz[7. Mayo Clinic, „Sodium: How to tame your salt habit”. Internet: http://www.mayoclinic.com/health/sodium/NU00284 (Stand: 11.2014).] :
- 5 % durch das Salzen beim Kochen
- 6 % durch das Salzen von nicht gekochten Lebensmitteln
- 12 % durch die Aufnahme von natürlichen Lebensmitteln
- 77 % durch industriell oder handwerklich produzierte Lebensmittel
- Wenn nur der Natriumwert angegeben ist, und man sich über den Natriumchloridgehalt informieren möchte, muss den Natriumwert mit dem Faktor 2,54 multiplizieren.
- Ab dem 13.12.2016 darf die Nährwertangabe „Natrium“ nicht mehr auf der Lebensmittelverpackung verwendet werden. Statt dessen muss der tatsächliche Salzgehalt angegeben werden. Die Bezeichnung lautet „Salz“. Wurde dem Lebensmittel kein Salz von außen zugesetzt, darf darauf hingewiesen werden, dass der Salzgehalt ausschließlich auf natürlich vorkommendes Natrium zurückzuführen ist.
- Das Kalium-Natrium-Verhältnis von raffiniertem Kochsalz beträgt 1 : 9712
- Medizin und Wissenschaft
- Maßeinheiten: Millimol (mmol), Mol (mol), Millival (mval)
- 1 g NaCl = 394 mg Natrium + 606 mg Chlorid = 17 mmol
- 1 mmol NaCl = 58,5 mg NaCl = 23,0 mg Natrium + 35,5 mg Chlor
- 1 mmol = 1 mval
- 1 mol NaCl = 58,5 g = 6,022 x 1023 Moleküle NaCl pro mol
- Laborwerte (Erwachsene):
- Kochsalzkonsum [g/Tag] = Natriumausscheidung im 24h-Sammelurin [mmol/Tag] x 0,06
- Natriummangel: Hyponatriämie = Serumnatriumwerte < 135 mmol/l
- Natriumüberschuss: Hypernatriämie = Serumnatriumwerte > 150 mmol/l
- Normalwert: 136-145 mmol/l
- Isotonische Kochsalzlösung: enthält 0,9 % Natriumchlorid (9 g NaCl in 991 g Wasser). Das entspricht in etwa dem Blut-Salzgehalt. Genutzt wird sie als Bestandteil von Infusionen, Medikamenten, Inhalationslösungen, Gurgel- und Nasenspülungen, Nasensprays.
- Sole: Kochsalz-Lösung mit einem Salzgehalt von 1,5 bis 6 %. Höhergesättigte Solen sind ebenfalls möglich (bis 30 %), sind aber nur selten Teil einer medizinischen Behandlung.
- Maßeinheiten: Millimol (mmol), Mol (mol), Millival (mval)
3. Natriumchlorid in unserem
Stoffwechsel
- Der Transport von Natrium- und Chloridionen in den Blutkreislauf erfolgt über spezielle Ionenkanäle der Dünndarmzellen.
- Der ph-Wert von Natriumchlorid liegt bei 5,65 und damit im sauren Bereich.
- Der Körper eines normalgewichtigen Erwachsenen enthält ca. 80-100 g Natrium (ca. 1,4 g pro kg Körpergewicht)
- 50% befinden sich in Körperflüssigkeiten außerhalb der Körperzellen (extrazellulär).
- 40-45% sind kristallin in Knochen, Knorpeln und Sehnen eingelagert.
- 5-10% befinden sich innerhalb der Körperzellen.
- Von Chlorid befinden sich ca. 80g in unserem Körper; davon
- 55% in Körperflüssigkeiten außerhalb der Körperzellen,
- 32% in Knochen, Knorpeln und Sehnen und
- 12% innerhalb der Zellen.
- Die Ausscheidung von Natrium und Chlorid erfolgt hauptsächlich über die Nieren mit dem Harn. Je nach körperlicher Anstrengung kann aber auch ein beträchtlicher Anteil über den Schweiß ausgeschieden werden.
- Bei Natrium liegt die Ausscheidung über den Urin bei 100-150 mmol, über den Stuhl 5 mmol und mit dem Schweiiß im Durchschnitt 25 mmol täglich ausgeschieden.
- Die normale Natriumkonzentration im Blutplasma (extrazellulär) beträgt 140 mmol/l (+- 5 mmol/l). Innerhalb der Zelle liegt sie ca. bei 15 mmol/l).
- Letale (tödliche) Dosis, LD50 (Dosis, bei der mindestens 50% der Menschen sterben): 1000 mg/kg Körpergewicht. Bei einem Kleinkind von 5 kg sind das 5 g Salz (ein gestrichener Teelöffel).
- Die Stoffwechselaufgaben von Natrium und Chlorid sind in vielen Funktionsbereichen eng miteinander verknüpft, deshalb lassen sich Stoffwechselreaktionen, die durch Kochsalzzufuhr ausgelöst werden, nicht immer klar der einen oder anderen Substanz zuschreiben. Häufig treten Reaktionen auch in Wechselwirkung miteinander auf oder bedingen sich gegenseitig.
|
Stoffwechselfunktion |
Natrium |
Chlorid |
|
Regelung des Wasserhaushalts |
x |
x |
|
Blutdruck |
x |
x |
|
Erhöhung der |
x |
x |
|
Aufbau und Härte der Knochen |
x |
x |
|
Unterstützung des Immunsystems |
x |
x |
|
Säuren-Basen-Haushalt |
x |
x |
|
Natrium-Kalium-Pumpe |
x |
|
|
Muskel- und Nervenimpulse |
x |
x |
|
Bestandteil der Magensäure (wichtig |
x |
|
|
Bestandteil der Ionenkanäle |
x |
x |
Schätzwerte für eine minimale Zufuhr
|
Alter |
Natrium |
Chlorid |
entspricht der |
|
Säuglinge |
|||
|
0 bis unter 4 Monate |
100 |
200 |
0,3 g |
|
4 bis unter 12 Monate |
180 |
270 |
0,45 g |
|
Kinder |
|||
|
1 bis unter 4 Jahre |
300 |
450 |
0,75 g |
|
4 bis unter 7 Jahre |
410 |
620 |
1,03 g |
|
7 bis unter 10 Jahre |
460 |
690 |
1,15 g |
|
10 bis unter 13 Jahre |
510 |
770 |
1,28 g |
|
13 bis unter 15 Jahre |
550 |
830 |
1,38 g |
|
Jugendliche und |
550 |
830 |
1,38 g |
Quelle: D-A-CH-Referenzwerte der DGE, ÖGE, SGE/SVE (Stand 2011)
- Maximal empfohlene Zufuhrempfehlung von Natriumchlorid für Jugendliche ab 16 Jahren und Erwachsene[8. Bundesinstitut für gesundheitlichen Verbraucherschutz und Veterinärmedizin (BgVV), „Gesundheitliche Bewertung des Salzgehalts industriell vorgefertigter Gerichte“, Stellungnahme des BgVV vom August 2001, S. 3. Internet: http://www.bfr.bund.de/cm/343/gesundheitliche_bewertung_des_salzgehalts_industriell_vorgefertigter_gerichte.pdf (Stand: 11.2014).] :
- DGE-Empfehlung 1985 u. 1991: 5 g/Tag
- DGE-Empfehlung ab 2000 bis heute: 6 g/Tag
- WHO-Empfehlung: < 5 g/Tag [9. World Health Organization 2007, „Prevention of Cardiovascular Disease“, Part 2, S. 23. Internet: http://www.who.int/cardiovascular_diseases/guidelines/PocketGL.ENGLISH.AFR-D-E.rev1.pdf (Stand: 11.2014).]
- Bundesinstitut für Risikobewertung (BfR)[21]:
- kritisch: > 5,8 g
- angemessene Menge: 3,8 g/Tag
- American Heart Association[10. Lawrence J. Appel, Michael W. Brands, Stephen R. Daniels et al., „Dietary approaches to prevent and treat hypertension“, Hypertension 2006; 47: 296-308. Internet: http://hyper.ahajournals.org/content/47/2/296.full (Stand: 11.2014).]
- Erwachsene, Heranwachsende und Schwangere: max. 5,8 g/Tag
Personen über 55 Jahre, Hochdruck- und Nierenkranke, Diabetiker: 3,8 g/Tag - Die Krebsforschungsorganisation World Cancer Research Fund (WCRF): < 5g/Tag[11. World Cancer Research Fund / American Institute for Cancer Research, „Food, Nutrition, Physical Activity, and the Prevention of Cancer: a Global Perspective“, Washington D. C.: AICR, 2007, S. 20. Internet: http://www.dietandcancerreport.org/cancer_resource_center/downloads/Second_Expert_Report_full.pdf (Stand: 11.2014).]
- Das National Institute for Health and Care Excellence (London): bis 2025 Reduktion auf 3 g/Tag[12. National Institute for Health and Care Excellence, NICE Public Health Guidance No. 25. London, June 2010. Internet: http://www.nice.org.uk/news/article/salt-reduction-strategy-could-prevent-thousands-of-deaths-from-cvd-says-nice (Stand: 11.2014).]
- durchschnittliche Aufnahme von Natriumchlorid in den Industrienationen (eigene Schätzung): 12-20 g
Copyright, Layout, Text, Grafik: Claus Barta
Alle Rechte der Verbreitung, der Übersetzung und der Vervielfältigung vorbehalten. Dies gilt auch für Fotokopie, Internet, Tonträger oder in einer anderen Form. Auszugsweise Nachdrucke sind nur mit schriftlicher Genehmigung gestattet.

